原子力システム研究開発事業及び原子力基礎基盤戦略研究イニシアティブ 成果報告会資料集
放射線誘発プリン介在型細胞間情報伝達の解明とがん治療への応用
(研究代表者)月本光俊 薬学部薬学科
(研究開発期間)平成20年度〜21年度
1.研究開発の背景とねらい
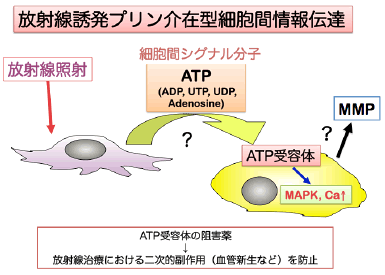
放射線照射は、がん細胞を殺滅する有効な治療手段として利用されている。しかし、放射線照射によって生き残ったがん細胞の悪性化や照射領域近傍の血管新生亢進は、放射線治療時の予後悪化の原因となるが、その原因は完全に明らかとなっていない。そのため、このような放射線の二次的影響の機序を明らかにし、その作用を阻害する薬剤が開発できれば放射線によるがん治療をより効率的にすることが可能となる。
近年、放射線照射による生物作用を検討する際、直接照射された細胞のみならず照射細胞周囲の非照射細胞においても放射線照射の影響がでることが明らかとなり、バイスタンダー効果と呼ばれている。バイスタンダー効果は、何らかの因子が照射細胞から非照射細胞へと情報を伝えていると考えられるが、その全容は未だ明らかにされておらずその解明が望まれている。このバイスタンダー効果は放射線の二次的影響に関与している可能性が高いため、バイスタンダー効果のメカニズムを明らかにし放射線による二次的影響の一端を解明することは重要な課題である。そこで本研究では、刺激に応じて細胞外に放出されるATPと細胞膜上に発現するATP受容体(P2受容体)に着目し、バイスタンダー効果の新規メカニズムを検討する。
ATPは、細胞内においてエネルギー供与体として働き、細胞外では通常非常に低い濃度に保たれている。しかし、細胞外からのストレス刺激によりATPは容易に細胞外へと放出され、細胞膜上に発現するATP特異的受容体(P2受容体)を活性化させることで、様々な生理作用を発現させる細胞間情報伝達物質としての機能を果たす。しかしながら、これまでに放射線による生物影響におけるATP受容体の関与について検討した報告はない。
そこで、本事業では、放射線がん治療時の副作用(血管新生亢進・がん浸潤能亢進)を阻害する薬剤の開発を目的として、放射線二次的影響へのATP受容体の関与について以下の研究項目の検討を行う。
(1) 放射線による生物影響におけるATP受容体の関与
(2) がん細胞からの放射線誘発matrix metalloproteinase (MMP)放出におけるATP受容体の関与
(3) マウスでの放射線誘発血管新生亢進に対するATP受容体阻害薬の効果
2.研究開発成果
【研究項目1】ヒト表皮HaCaT細胞においてγ線照射(0.1-1.0 Gy)により細胞からATPが放出されることが明らかになった。このATP放出は、細胞障害ではなくアニオンチャネルなどを介していることが示唆された。γ線照射によりextracellular signal regulated protein kinase1/2(ERK1/2)が活性化する。このERK1/2活性化は、細胞外ヌクレオチド分解酵素やP2Y6受容体阻害薬の処置により抑制された。これらの結果から、γ線照射によってATPなどのヌクレオチドが放出され、放出された細胞外ATPによりP2Y6受容体を含むATP受容体が活性化し、ERK1/2が活性化しているメカニズムが示唆された。
【研究項目2】がん細胞(マウスB16メラノーマ)においてγ線照射によりATPの放出が認められた。また、照射によりMMPの放出が認められた。照射によるMMP放出はP2X7受容体阻害薬によって阻害されたため、がん細胞からのMMPの放出にP2X7受容体活性化が関与することが示唆された。研究項目1, 2の結果により、放射線生物影響におけるATP受容体活性化の関与がin vitroにおいて示された。
【研究項目3】放射線による二次的影響におけるATP受容体の関与をin vivoのモデルにおいて検討した。二次的影響としては放射線誘発血管新生に着目し検討した。マウスの大腿動脈を結紮する後肢虚血モデルを用いて検討した。虚血手術後2週間、全身の血流量をレーザードップラー式血流画像解析装置により画像解析した。γ線(0.5 Gy)照射によってより早期に後肢虚血部位の血流量が回復し、放射線による血管新生亢進が示された。P2X7受容体阻害薬を照射前に投与したところ、γ線による血管新生亢進が抑制されることが示された。この結果は、がん放射線治療時において、照射前にP2X7受容体阻害薬を投与しておくことで放射線による血管新生亢進を抑制することができ、より効率よく放射線治療を行うことが出来る可能性を示した。今回の研究では血管新生に着目したが、ほかにも放射線の二次的影響であるがん細胞の転移促進効果などさまざまな現象に細胞外ATPとATP受容体の活性化が関与している可能性が考えられる。
3.今後の展望
本研究によって、放射線誘発プリン介在型細胞間情報伝達(Radiation-induced purinergic signaling)という新たな放射線生物学のパラダイムが示唆された。近年、照射細胞からさまざまな因子が細胞外に放出されて周囲の細胞に作用を及ぼすバイスタンダー効果が注目されている。ATPはどの細胞にも存在するため、さまざまな細胞における放射線生物作用(バイスタンダー効果含む)に関与している可能性が高い。今後さまざまな放射線生物作用においてATP受容体の関与を検討することにより、放射線の新たな作用機序が明らかになってくると考えられ、大きな波及効果が期待できる。
また、放射線生物影響における副次的影響をより正確に把握することができるようになれば、より効果的な放射線治療を実現することが可能となる。ATP受容体阻害薬の照射前投与は、多くの放射線治療において応用の可能性があるため、放射線治療患者の生存率向上やがん再発・転移防止において貢献が期待できる。本研究では放射線照射による血管新生亢進作用に注目したが、今後は、放射線抵抗性、がん悪性化、炎症、線維化への関与など、さまざまな放射線生物作用におけるATP受容体の関与を検討し、より良い放射線がん治療を実現するための新薬の創出に貢献していきたい。
