原子力システム研究開発事業及び原子力基礎基盤戦略研究イニシアティブ 成果報告会資料集
先進的ながん診断・治療を実現するRI−DDS開発研究
(研究代表者)橋本和幸 量子ビーム応用研究部門
(再委託先)株式会社千代田テクノル、国立大学法人東京大学、国立大学法人京都大学、
国立大学法人千葉大学、国立大学法人群馬大学
(研究開発期間)平成20年度〜22年度
1.研究開発の背景とねらい
放射性同位元素(RI)を利用するがんの内用放射線治療は標的とする身体内の病巣の組織や細胞にRIを送り込み、そのRIから出る飛程の短い放射線(β、α線など)で病巣の組織や細胞を照射することによって、正常な身体組織や細胞への放射線の影響を低く押さえながら、目的とする病巣の組織や細胞を破壊して疾患を治療する方法であり、がん細胞が全身の臓器・組織に転移し、散在しているような場合でも、有効な治療が行える。これは手術、外部照射放射線療法では得られない内用放射線治療の利点である。さらに、がん細胞の内部へ薬物を運ぶ必要がある従来の抗癌剤療法と異なり、β線の場合は数ミリ程度の飛程(放射線が通過する範囲)を有するため、放射性薬剤が全てのがん細胞に結合する必要は無く、RIをがん細胞周辺に集積させる事ができれば、がん細胞を死滅させることが可能となる。また、放射性薬剤は、従来の抗癌剤のような耐性や依存性もなく、1回の投与で効果が長時間持続するなど、患者のQOL(生活の質)の向上に繋がり、がん治療に新しい可能性を与えることができる全く新しいタイプの抗癌剤である。さらに、治療対象とする腫瘍の大きさに応じて、さまざまな飛程の異なるβ線放出RIを使い分ける可能性を有していることも利点と考えられている。
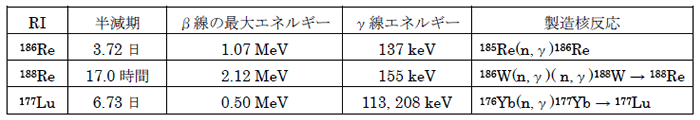
そこで本事業では、RIを用いたがん治療と診断(モニタリング)を可能にする放射性薬剤の開発を目指し、表に示したがん治療に適したエネルギーのβ線及び体外からの非侵襲的な画像診断法である核医学イメージングに適したγ線を同時に放出し、半減期も数日程度であり、かつ治療効果を高める上で、高比放射能での製造が可能な優れた特性を持つレニウム-186, 188(186,188Re)及びルテチウム-177(177Lu)を用いたドラッグデリバリーシステム(RI-DDS)の基盤技術を開発することを目的とし、がん治療用高比放射能RIの製造技術の開発、放射性レニウム標識化合物の実用的調製法の開発、体内動態の化学的、生物学的制御によるRI-DDSを基盤としたレニウム標識抗体製剤の開発、RI-DDSに適したレニウム標識ペプチドの開発及び177Lu標識抗体の合成及び特性評価研究を3年計画(平成20〜22年度)で実施している。
2.研究開発成果
(1)がん治療用高比放射能RIの製造技術の開発
① PZCを利用した188W/188Re新規ジェネレータの開発
188Reは、親核種であるタングステン-188(188W(半減期69.4日))のβ−崩壊により生成する娘核種であるために高比放射能(無担体)であり、数ヶ月間繰り返し入手することが可能である。しかしながら、188Wは186Wの二重中性子捕獲反応(186W(n,γ)187W(n,γ)188W)により製造するため、比放射能が低く、従来から使用されているアルミナジェネレータではカラム容積が大きくなる。そこで、小型の新規188W/188Reジェネレータの開発をタングステンの吸着容量がアルミナの数十倍以上もあるジルコニウム系無機高分子PZCを用いて実施した。
トレーサー量の188Wを使用して、再現性の良い188WのPZCへの高吸着条件を確立するために、188WのPZCへの吸着プロセス時のpH調整に関して、詳細に検討した。初期pHを段階的に変化させて吸着反応を実施した結果、PZCの製造ロット、粒径の違いにより、pH変化及び吸着率に若干の違いが見られるが、初期pHが7.3〜12の場合、反応終了時のpHは、4〜7(吸着反応に適しているpH領域)であり、吸着率は、75%以上(75-100%)であった。今後、さらに、188WのPZCへの高い吸着率を安定して得るための条件を精査すると共に、放射能量を増やした場合の特性について検討する。
② 186Re,188W大量製造技術の開発
濃縮度97.4%の185Reターゲットを用いた185Re(n,γ)反応により製造する186Re及び濃縮度99.79%の186Wターゲットを用いた186W(n,γ)187W(n,γ)反応により製造する188Wの大量製造技術基盤・体制を構築し、8〜10 GBqの186Re、 250〜1000 MBqの188Wの定常製造を可能にした。製造した186Re,188Wは、各大学へ提供し、研究の進展に寄与した。また、製造装置の検討を実施し、装置の問題点・改良点についての知見を得るとともに、製造工程上の問題点も見出した。
③ 高純度無担体177Luの大量製造法の開発
177Luは、通常176Lu(n,γ)177Lu 反応を利用して製造されるが、無担体の177Luを製造するためには、イッテルビウム-176(176Yb)をターゲットとする176Yb(n,γ)177Yb(半減期1.91時間)→ 177Lu反応を利用した技術の確立が必要である。しかし、LuとYbの化学的性質の類似性から単独の分離方法により効率よく完全分離を達成するのは難しい。そこで、我々は、高放射能量(GBqオーダー)でかつ抗体標識が可能な高純度無担体177Luの製造法の確立を目指して、固相抽出分離カラム法(第1分離法)と逆相シリカゲルカラム法(第2分離法)を組み合わせた分離方法を検討した。
従来の研究結果から、第2分離法に採用した逆相シリカゲルカラム法を用いて、マクロ量のYbから無担体Luを完全に分離するためには、ターゲット物質であるYb2O3の量が2.5 mg以下である必要がある。そこで、第1分離法によるYbとLuの分離挙動に対するYb2O3量依存性を調べた。その結果、Yb2O3量が10 mgまでは、177Luフラクション中に含まれるYb2O3量は、全体の18%以下(1.8 mg)であり、第2分離法と組み合わせることにより、GBqオーダーの177LuをYb2O3から分離できることが示唆された。次に、第2分離法の問題点であった不純物元素による抗体標識阻害を解決するために、高純度な177Luを得るための精製法の検討を行った。その結果、分離に使用する試薬をイオン交換カラムおよびキレートカラムにより精製すること、並びに、分離後の無担体177Luを陽イオン及び陰イオン交換カラムにより精製することにより、抗体標識が可能な高純度無担体177Luが得られることを明らかにした。今後は、標識抗体を用いた動物実験が可能な数百MBqレベルの高純度無担体177Luの製造技術を確立すると共に、固相抽出カラム法と逆相シリカゲルカラム法を組み合せ、GBqレベルの高純度無担体177Luの製造技術の確立を目指す。
(2)放射性レニウム標識化合物の実用的調製法の開発
放射性レニウム標識化合物をがん治療に利用する場合、治療現場で標識し易いように、合成法は穏和でかつ簡便であることが望ましい。そこで、本研究では、骨に集積するために、癌性骨疼痛緩和作用が期待されているジメルカプトコハク酸 (DMSA)の放射性レニウム標識化合物、及びがん集積性を持つ生理活性物質(抗体等)へ放射性レニウムを導入するために有用な中間体と考えらえているMAG3化合物、トリカルボニルレニウム化合物の合成条件を精査し、高収率で得られる条件を探索している。
DMSA化合物については、95%以上の収率で合成できる至適条件を見出した。本条件で合成したDMSA化合物の構造はNMRなどの分析結果からRe(DMSA)2と推定される。
188Re-MAG3の合成条件は、核医学診断用薬剤として使用されているテクネチウム-99m(99mTc)-MAG3の合成条件に比べて、還元剤である塩化第一スズの量を多く必要とし、加熱時間も90℃で25分以上を要する事がわかった。また、188Re-トリカルボニル化合物は、反応終了時のpHが中性であると収率が高くなる事が分かった。今後、試薬の量の比、とそれらの混合順序、反応温度・時間などの改善により、収率の向上を目指すとともに、キット化の検討を行い、その実用性について調べる。
(3) 体内動態の化学的、生物学的制御によるRI-DDSを基盤としたレニウム標識抗体製剤の開発
放射免疫療法は、腫瘍細胞に発現する抗原を標的とし、RIで標識した抗体を投与することで腫瘍に放射線を照射する内用放射線治療の一つである。しかし、高分子である抗体の血中クリアランスが一般的に遅いため、放射線感受性の高い骨髄における被曝量の増大が問題となっている。そこで本研究では、プレターゲティング法の概念に基づき、ビオチン-ストレプトアビジンの特異的2分子間相互作用を利用した新規レニウム標識RI-DDS内用放射線治療薬剤の開発を行っている。すなわち、I. 腫瘍細胞膜上の特異的抗原を標的とする抗体にストレプトアビジンを結合させた「ストレプトアビジン化抗体」を投与する。II. 抗原抗体反応により、ストレプトアビジン化抗体が腫瘍抗原に結合する。III. 血中からのストレプトアビジン化抗体の消失を待った後、「放射性レニウム標識ビオチン」を投与する。IV. ビオチン-ストレプトアビジン複合体の形成を介し、放射性レニウムが腫瘍細胞に集積する。以上の工程から、骨髄被曝の低減と腫瘍選択的な放射線照射の実現を目指す。
まず、ストレプトアビジンとの結合性の保存を考慮した放射性レニウム標識ビオチンを新規に設計・合成し、安定性とストレプトアビジンに対する結合性をインビトロで確認した。次に、本化合物を動物に投与し、その生体内挙動を測定した結果、速やかな血中クリアランスと尿排泄性を有していたことから、プレターゲティング法への適用の可能性が示された。さらに、ストレプトアビジン化抗体存在下における癌細胞および担癌モデル動物を用いた実験から、腫瘍への放射能集積に関する知見が得られ、新たに設計したプレターゲティングシステムを内用放射線治療へと展開できる可能性が示された。今後、さらにその検討を続け、プレターゲティング法の概念に基づいた放射性レニウム内用治療の可能性を総合的に評価する。
(4)RI-DDSに適したレニウム標識ペプチドの開発
数個のアミノ酸から構成される合成ソマトスタチンや環状RGDペプチドは、速やかな腫瘍への集積と血液クリアランスからRI-DDSにおけるRIの運搬体として、その利用が進められている。しかしRI標識ペプチドを生体内に投与すると、投与早期から腎臓へ長時間に渡り滞留するため,診断精度の低下や治療時の副作用を招き、臨床使用の大きな障害となっている。この問題が解消されれば、投与早期からの精度の高い画像診断が可能になり、治療時においても副作用の低減や治療効果の向上が期待される。そこで本研究では、簡便な操作でレニウム標識ペプチドが作製でき、その腎臓への集積を低減する標識薬剤を開発することを目的とした。
まず、放射性レニウムと低濃度においても定量的な収率で安定な化合物(錯体)を生成する二官能性キレート試薬(配位子)の開発・評価を実施した。その結果、イソニコチン酸を母体とするトリアミン誘導体が、低配位子濃度においても放射性レニウムおよび99mTcと安定な錯体を形成することを認めた。さらにこれらの錯体は、過剰の配位子を除去した場合でも血漿中で安定に存在することを確認した。次に、本化合物に、化学修飾を施し、その放射性レニウムおよび99mTc錯体を投与した際に、肝臓への集積を示すことなく、速やかに腎臓から尿中へと排泄を受ける化合物を選出した。今後、上記の研究から選出した化合物に様々なペプチドリンカーを導入し、腎臓刷子縁膜酵素により認識を受けて、尿排泄性の186/188Reまたは99mTc錯体を選択的に遊離する化合物の開発を目指す。
(5)177Lu標識抗体の合成及び特性評価研究
半減期が比較的長く(6.73日)、β線のほかγ線も放出するため治療と同時に診断も行える利点を有する177Luを用いた、より治療効果の高い放射免疫療法薬剤開発を目標とする。種々のがん細胞を移植した担癌マウスにおける腫瘍集積性、体内分布を検討し、治療効果が得られるだけの腫瘍集積性があるかどうかを評価した。高い集積性が認められた腫瘍、抗体の組み合わせに対して、177Lu抗体による治療実験を実施した。
悪性リンパ腫細胞株(RAMOS)および大腸癌細胞株を移植した担癌マウスを作製し、177Lu標識抗体を投与したところ、177Lu標識抗体は高い腫瘍への集積性と滞留性を示し、高い治療効果が期待された。2種類の担癌マウスに対して177Lu標識抗体を投与し、経過観察を行ったところ、腫瘍の増殖抑制効果が認められ、RAMOS細胞移植マウスを用いた検討においては腫瘍の消失例も確認できた。また同担癌マウスを用いて177Luの代わりに臨床にも用いられているイットリウム-90(90Y)で標識した抗体による治療実験を行ったところ、両担癌マウスモデルにおいて腫瘍増殖抑制効果は認められたが、腫瘍縮小には至らなかった。このことから少なくともがんの種類によっては177Lu標識抗体の方が高い治療効果が期待できる可能性が示された。今後はさらに多くのマウスに対して治療実験を行うととともに、他の抗体、腫瘍の組み合わせについても検討を行う。また177Lu標識抗体と90Y標識抗体との治療効果の比較をより詳細に検討し、177Luの核種としての有用性を評価する。
3.今後の展望
本事業を通じて構築したRI大量製造・供給体制及びRI薬剤開発研究ネットワークを今後も活用・拡充し、がん治療に有用な特性を持つ186,188Re及び177Luを用いたRI-DDSの基盤技術開発を着実に進展させ、RIを用いたがん治療と診断(モニタリング)を可能にするRI薬剤の実用化を目指した研究開発に貢献する。
